Disbiosi intestinale, immunità e malattie infiammatorie
Numerosi studi attribuiscono ai probiotici diversi effetti benefici su patologie gastrointestinali, tra cui quelle infiammatorie. Ecco i benefici derivanti dal consumo di prodotti contenenti probiotici.
SOMMARIO USCITA 101:
- Dieta, stile di vita e disbiosi
- Disbiosi intestinale, immunità e malattie infiammatorie
- Latticini fermentati e immunità
- Cosa dicono gli studi clinici
- Conclusioni e prospettive
La disbiosi, la perdita di integrità della barriera intestinale e la disregolazione del sistema immunitario sono ben noti fattori patogenetici di diverse patologie umane, intestinali e sistemiche (3, 17) e le evidenze scientifiche sono ormai concordi nell’attribuire ai probiotici effetti benefici in diverse malattie gastrointestinali, comprese quelle infiammatorie (16, 18), in quanto favoriscono il mantenimento della barriera intestinale attraverso vari meccanismi (19, 20) che possiamo raggruppare in questo modo:
Latticini fermentati e immunità
Queste componenti hanno un impatto favorevole sulla prevenzione dell’eccesso di peso corporeo, sull’ipertensione, sul metabolismo glucidico, sulla sensibilità all’insulina e sull’insulino-resistenza (25-28).
Poiché migliorano anche l’escrezione renale di sodio, bloccano i canali del calcio, riducono le concentrazioni di calcio intracellulare e aumentano la sintesi di ossido nitrico (29-31), si può spiegare in questo modo anche l’azione sulla pressione arteriosa.
Ma queste componenti sono contenute sia nei prodotti interi che in quelli a basso contenuto di grasso e quindi gli autori attribuiscono la maggiore protezione da parte dei prodotti a basso contenuto di grasso con il possibile effetto di saturi e/o sale di ostacolo all’assorbimento di calcio e magnesio, contrastandone gli effetti favorevoli; c’è anche da dire però che il numero di studi che differenzia il consumo di prodotti interi è ancora piuttosto basso.
Inoltre, questo risultato può non essere tanto dovuto al minore consumo di grassi saturi o sale, quanto piuttosto alla maggiore attenzione all’alimentazione, alla salute, alla scelta di stili di vita più sani e attivi nelle persone che scelgono latticini a basso contenuto di grassi. Per quanto riguarda il sovrappeso o l’obesità, l’associazione tra latticini a basso contenuto di grassi invece non è significativa e questo può essere dovuto al fatto che solamente due studi sono stati idonei ad essere inclusi nella meta-analisi e si rendono pertanto necessari ulteriori studi per confermare o disconfermare questi risultati.
Il consumo di yogurt è invece altamente e coerentemente correlato con la diminuzione del rischio per tutti e tre gli esiti di salute e gli autori chiamano in causa diversi meccanismi: i nutrienti nello yogurt possono essere più biodisponibili rispetto ad altri prodotti lattiero-caseari (32) e il calcio può ridurre la lipogenesi e aumentare la lipolisi mediante la soppressione della formazione di 1,25 diidrossivitamina D e la secrezione dell’ormone paratiroideo, oltre che mediante la promozione della formazione di saponi di calcio nell’intestino, con conseguente aumento dell’escrezione e riduzione dell’assorbimento dei grassi. Ma questo è un effetto che è condiviso da tutti i prodotti lattiero caseari. La differenza fondamentale tra yogurt e altri prodotti del gruppo, o almeno molti di questi, è la fermentazione.
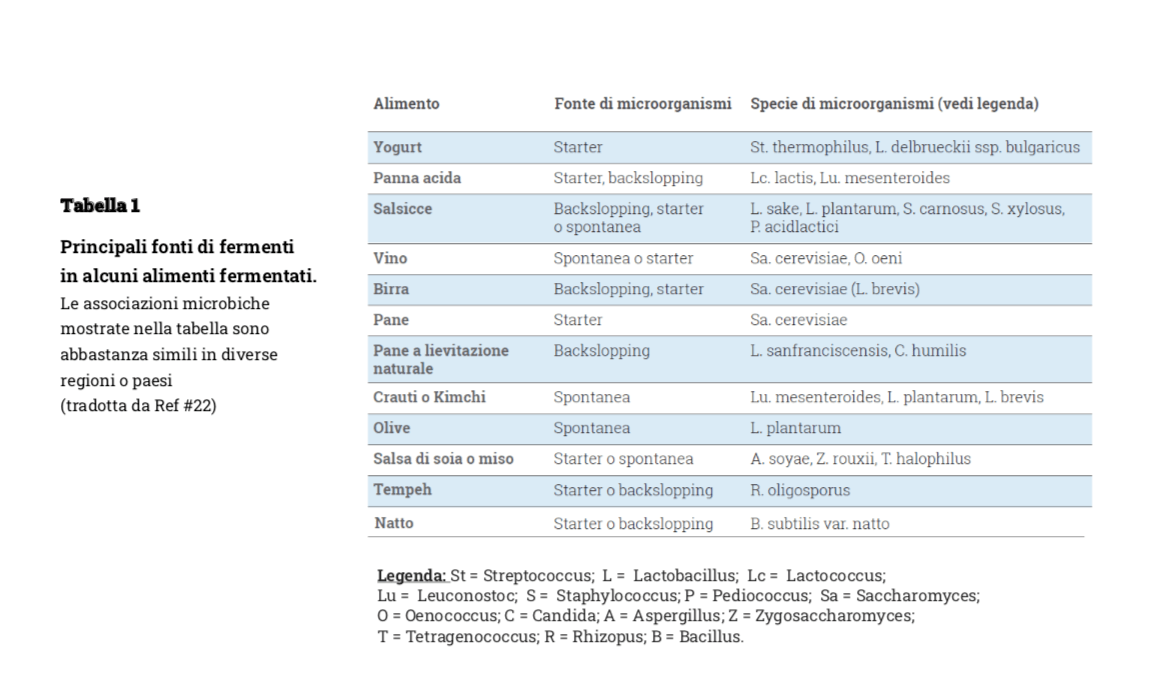
I prodotti fermentati, soprattutto latte e formaggi, sviluppati come strategia per la conservazione delle importanti proprietà nutritive di alimenti deperibili come il latte, rappresentano una parte importante della dieta dell’uomo fin dallo sviluppo delle civiltà umane (21). Si tratta di alimenti prodotti attraverso la crescita, spontanea o indotta tramite starter o aggiunta di una fermentazione precedente (backspalling), di una popolazione microbica ben controllata sia dal punto di vista della numerosità cellulare che delle reazioni enzimatiche che portano alle componenti alimentari maggiori e minori tra le quali quelle aromatiche. Data la moltitudine delle combinazioni alimento-fermento esistono migliaia di tipi diversi di alimenti fermentati e in Tabella 1 sono riportate le principali, più diffuse, classi di alimenti fermentati, le modalità di fermentazione e le relative specie batteriche caratteristiche.
Nonostante la grande varietà di prodotti e la loro lunga storia, popolarità e ruolo nutrizionale, la transizione alimentare avvenuta un po’ ovunque, ma più marcatamente in Occidente di cui abbiamo parlato nell’introduzione, ha comportato nel corso dell’ultimo secolo una drastica riduzione della varietà degli alimenti fermentati (22), anche se negli ultimi anni si sta risvegliando un crescente interesse verso questi prodotti, sostenuto dalle crescenti evidenze di un ruolo chiave nella promozione della salute e addirittura alcuni gruppi di ricerca ne suggeriscono l’inclusione nelle Linee Guida per la sana alimentazione (23, 24).
I principali batteri, utilizzati come starter in molti processi lattiero-caseari, sono i batteri lattici (LAB) necessari per produrre yogurt, latti fermentati, panna, burro e formaggi. Il ruolo principale dei LAB è quello di abbassare il pH attraverso la fermentazione del lattosio in acido lattico, e ciò inibisce il deterioramento del latte e lo sviluppo di flora patogena, oltre che produrre componenti aromatiche desiderabili come per esempio diacetile e acetoino, due componenti che conferiscono sapore “burroso”.
Le principali specie di LAB riscontrate nei prodotti lattiero-caseari fermentati sono il Lactococcus lactis, lo Streptococcus salivarius subsp. thermophilus (S. thermophilus) e lattobacilli come Lactobacillus delbrueckii ssp negli yogurt e latti fermentati e Lactobacillus helveticus nei formaggi svizzeri. Molti altri microrganismi sono presenti anche all’interno dei formaggi, come i propionibatteri (PAB) nei formaggi di tipo svizzero, o sulla superficie dei formaggi, come muffe e lieviti (2). Ma LAB e PAB, oltre al loro ruolo nella genesi delle qualità complessive dei prodotti lattiero-caseari fermentati, hanno anche un ruolo essenziale nella salute umana e nell’omeostasi intestinale.
A cura di: Prof. Andrea Ghiselli, Direttore del Master di I livello in Scienza dell’Alimentazione e Dietetica Applicata, Unitelma Sapienza, Roma.
1. Fardet, A. and E. Rock, Ultra-processed foods: A new holistic paradigm? Trends in Food Science & Technology, 2019. 93: p. 174-184.
2. Illikoud, N., et al., Dairy starters and fermented dairy products modulate gut mucosal immunity. Immunol Lett, 2022. 251-252: p. 91-102.
3. Kopp, W., How Western Diet And Lifestyle Drive The Pandemic Of Obesity And Civilization Diseases. Diabetes Metab Syndr Obes, 2019. 12: p. 2221-2236.
4. Maloy, K.J. and F. Powrie, Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature, 2011. 474(7351): p. 298-306.
5. Maslowski, K.M. and C.R. Mackay, Diet, gut microbiota and immune responses. Nat Immunol, 2011. 12(1): p. 5-9.
6. Desai, M.S., et al., A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell, 2016. 167(5): p. 1339-1353 e21.
7. Nickerson, K.P., et al., The dietary polysaccharide maltodextrin promotes Salmonella survival and mucosal colonization in mice. PLoS One, 2014. 9(7): p. e101789.
8. Nickerson, K.P. and C. McDonald, Crohn’s disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One, 2012. 7(12): p. e52132.
9. Chassaing, B., et al., Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. Gut, 2017. 66(8): p. 1414-1427.
10. Suez, J., et al., Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 2014. 514(7521): p. 181-6.
11. Ruiz, P.A., et al., Titanium dioxide nanoparticles exacerbate DSS-induced colitis: role of the NLRP3 inflammasome. Gut, 2017. 66(7): p. 1216-1224.
12. Mao, Z., et al., Exposure to Titanium Dioxide Nanoparticles During Pregnancy Changed Maternal Gut Microbiota and Increased Blood Glucose of Rat. Nanoscale Res Lett, 2019. 14(1): p. 26.
13. Bettini, S., et al., Food-grade TiO(2) impairs intestinal and systemic immune homeostasis, initiates preneoplastic lesions and promotes aberrant crypt development in the rat colon. Sci Rep, 2017. 7: p. 40373.
14. Guo, Y., et al., A diet high in sugar and fat influences neurotransmitter metabolism and then affects brain function by altering the gut microbiota. Transl Psychiatry, 2021. 11(1): p. 328.
15. Ianiro, G., H. Tilg, and A. Gasbarrini, Antibiotics as deep modulators of gut microbiota: between good and evil. Gut, 2016. 65(11): p. 1906-1915.
16. Ghosh, S., et al., Regulation of Intestinal Barrier Function by Microbial Metabolites. Cell Mol Gastroenterol Hepatol, 2021. 11(5): p. 1463-1482.
17. Ocvirk, S., et al., A prospective cohort analysis of gut microbial co-metabolism in Alaska Native and rural African people at high and low risk of colorectal cancer. Am J Clin Nutr, 2020. 111(2): p. 406-419.
18. Sanders, M.E., et al., Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nat Rev Gastroenterol Hepatol, 2019. 16(10): p. 605-616.
19. do Carmo, F.L.R., et al., Extractable Bacterial Surface Proteins in Probiotic-Host Interaction. Front Microbiol, 2018. 9: p. 645.
20. Lebeer, S., J. Vanderleyden, and S.C. De Keersmaecker, Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Nat Rev Microbiol, 2010. 8(3): p. 171-84.
21. Hutkins, R.W., Microbiology and technology of fermented foods. 2008: John Wiley & Sons.
22. Marco, M.L., et al., Health benefits of fermented foods: microbiota and beyond. Curr Opin Biotechnol, 2017. 44: p. 94-102.
23. Ebner, S., et al., Probiotics in dietary guidelines and clinical recommendations outside the European Union. World J Gastroenterol, 2014. 20(43): p. 16095-100.
24. Chilton, S.N., J.P. Burton, and G. Reid, Inclusion of fermented foods in food guides around the world. Nutrients, 2015. 7(1): p. 390-404.
25. Rul, F., et al., Underlying evidence for the health benefits of fermented foods in humans. Food Funct, 2022. 13(9): p. 4804-4824.
26. Olivares, M., et al., Dietary deprivation of fermented foods causes a fall in innate immune response. Lactic acid bacteria can counteract the immunological effect of this deprivation. J Dairy Res, 2006. 73(4): p. 492-8.
27. Chen, Y., et al., Yogurt improves insulin resistance and liver fat in obese women with nonalcoholic fatty liver disease and metabolic syndrome: a randomized controlled trial. Am J Clin Nutr, 2019. 109(6): p. 1611-1619.
28. Zarrati, M., et al., Effects of probiotic yogurt on fat distribution and gene expression of proinflammatory factors in peripheral blood mononuclear cells in overweight and obese people with or without weight-loss diet. J Am Coll Nutr, 2014. 33(6): p. 417-25.
29. van Meijl, L.E. and R.P. Mensink, Effects of low-fat dairy consumption on markers of low-grade systemic inflammation and endothelial function in overweight and obese subjects: an intervention study. Br J Nutr, 2010. 104(10): p. 1523-7.
30. Pei, R., et al., Premeal Low-Fat Yogurt Consumption Reduces Postprandial Inflammation and Markers of Endotoxin Exposure in Healthy Premenopausal Women in a Randomized Controlled Trial. J Nutr, 2018. 148(6): p. 910-916.
31. Bordoni, A., et al., Dairy products and inflammation: A review of the clinical evidence. Crit Rev Food Sci Nutr, 2017. 57(12): p. 2497-2525.
32. Rundblad, A., et al., Intake of Fermented Dairy Products Induces a Less Pro-Inflammatory Postprandial Peripheral Blood Mononuclear Cell Gene Expression Response than Non-Fermented Dairy Products: A Randomized Controlled Cross-Over Trial. Mol Nutr Food Res, 2020. 64(21): p. e2000319.
33. Nieman, K.M., B.D. Anderson, and C.J. Cifelli, The Effects of Dairy Product and Dairy Protein Intake on Inflammation: A Systematic Review of the Literature. J Am Coll Nutr, 2021. 40(6): p. 571-582.
34. Sugimura, T., et al., Immunomodulatory effect of Lactococcus lactis JCM5805 on human plasmacytoid dendritic cells. Clin Immunol, 2013. 149(3): p. 509-18.