Probiotici, latticini fermentati, disbiosi e immunità
Il tratto gastrointestinale umano ospita oltre 1.000 microbi appartenenti a 1.000 specie, tutti fondamentali per la salute perché influenzano lo sviluppo della nutrizione dell’ospite, la modulazione del sistema immunitario e la funzione della barriera intestinale.
SOMMARIO USCITA 101:
- Dieta, stile di vita e disbiosi
- Disbiosi intestinale, immunità e malattie infiammatorie
- Latticini fermentati e immunità
- Cosa dicono gli studi clinici
- Conclusioni e prospettive
Uno dei tratti caratteristici delle diete occidentali moderne è la transizione verso uno stile di vita più sedentario e verso un’alimentazione ipercalorica, povera di fibra, ma ricca di alimenti troppo raffinati e modificati, come oli, grassi idrogenati e non, zuccheri e dolcificanti, amido più o meno modificato, proteine trasformate e vari additivi alimentari, che rendono il cibo altamente appetibile ma spesso ricco di calorie vuote e inutili (1).
A ciò si affianca un uso troppo frequente e spesso scorretto di farmaci, con particolare riguardo agli antibiotici (2).
In Italia, come in altri Paesi occidentali, si aggiunge oltretutto un consumo molto scarso di latte e quasi inesistente di yogurt o altri latti fermentati.
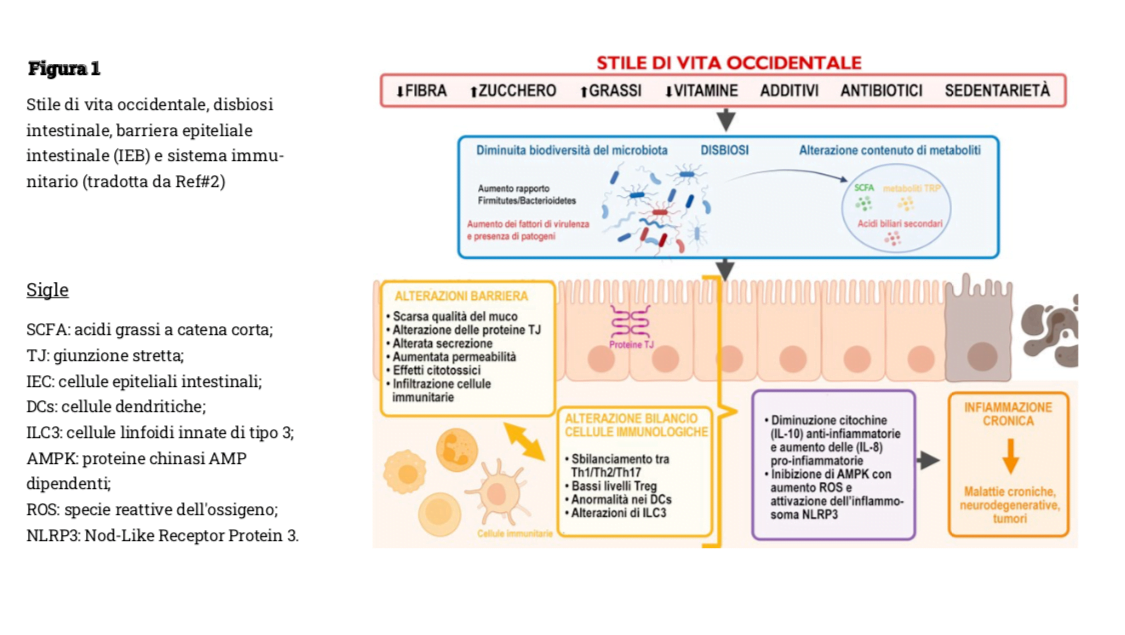
Tutto questo favorisce la disbiosi intestinale, con la perdita del naturale equilibrio, diminuzione della biodiversità microbica e alterazione del contenuto dei metaboliti microbici, che comporta un’alterazione della barriera epiteliale intestinale, una perdita dell’equilibrio tra le cellule immunitarie e sviluppo e progressione di condizioni di infiammazione cronica, come si può vedere nella Figura 1, compromissione dell’immunità intestinale/generale e aumentato rischio di malattie croniche non trasmissibili (2), come obesità, diabete e malattie cardiovascolari (3).
L’omeostasi intestinale è un equilibrio molto fragile, finemente regolato da complesse interazioni tra la barriera epiteliale intestinale (IEB), il microbiota intestinale, il sistema immunitario e il sistema nervoso enterico (ENS) (4).
Dieta, stile di vita e disbiosi
La carenza di fibra può portare alla modifica dell’omeostasi intestinale sia direttamente, per mancanza di nutrimento, sia indirettamente attraverso la diminuzione di acidi grassi a catena corta (SCFA) che, abbassando il pH del lume intestinale, inibiscono la crescita oltre misura di batteri patogeni (5), e mantengono una migliore qualità del muco, migliorando quindi la protezione complessiva della mucosa (6).
Il consumo di additivi alimentari invece ha un ventaglio di conseguenze differenti a seconda dell’additivo consumato: le maltodestrine, ampiamente utilizzate come addensanti, modificano la colonizzazione batterica della mucosa (almeno nel modello animale), aumentando i livelli di batteri patogeni come Salmonella ed Escherichia coli (7, 8).
Alcuni emulsionanti, come il polisorbato e la carbossimetilcellulosa hanno un potenziale proinfiammatorio nell’uomo (9). Il consumo di dolcificanti artificiali acalorici può indurre, nel breve e nel lungo termine, a disbiosi (10).
Un’altra caratteristica preoccupante del consumo troppo generoso di prodotti ultraprocessati è la presenza di grandi quantità di microparticelle (>1012/giorno) derivate da additivi alimentari, che possono influenzare l’omeostasi intestinale.
Il biossido di titanio (TiO2) per esempio è uno dei coloranti alimentari sbiancanti più utilizzati e molti studi ne indicano effetti proinfiammatori, alterazione del microbiota intestinale e dell’IEB con traslocazione batterica (11-13) e una esposizione di lunga durata è responsabile di indurre infiammazione di basso grado (13).
Questa infiammazione può essere spiegata dagli effetti sul microbiota e sulla barriera intestinale. Infatti, i ratti esposti a TiO2 presentavano una diminuzione degli SCFA e un aumento dei peptidi antimicrobici a suggerire un’alterazione del microbiota intestinale.
Per quello che riguarda l’uso troppo frequente di farmaci, gli antibiotici agiscono ovviamente in maniera diretta sul microbiota intestinale e un uso eccessivo favorisce lo sviluppo di malattie croniche come le malattie infiammatorie intestinali (IBD), sindrome dell’intestino irritabile (IBS) (15), oltre che la compromissione dell’IEB e aumenta l’infiammazione. Gli antibiotici inducono una diminuzione della diversità microbica, uccidendo sia microrganismi patogeni (motivo del loro utilizzo) sia quelli benefici, e ciò a sua volta comporta una diminuzione delle cellule T nell’intestino.
I batteri all’interno del lume intestinale modulano l’omeostasi intestinale e la funzione di barriera.
Il tratto gastrointestinale umano ospita circa 1014 microbi appartenenti a 1000 specie. Questo numero è più di 10 volte il numero di cellule umane eucariotiche ed è fondamentale per la salute umana poiché influenza lo sviluppo della nutrizione dell’ospite, la modulazione del sistema immunitario e la funzione della barriera intestinale (16).
A cura di: Prof. Andrea Ghiselli, Direttore del Master di I livello in Scienza dell’Alimentazione e Dietetica Applicata, Unitelma Sapienza, Roma.
1. Fardet, A. and E. Rock, Ultra-processed foods: A new holistic paradigm? Trends in Food Science & Technology, 2019. 93: p. 174-184.
2. Illikoud, N., et al., Dairy starters and fermented dairy products modulate gut mucosal immunity. Immunol Lett, 2022. 251-252: p. 91-102.
3. Kopp, W., How Western Diet And Lifestyle Drive The Pandemic Of Obesity And Civilization Diseases. Diabetes Metab Syndr Obes, 2019. 12: p. 2221-2236.
4. Maloy, K.J. and F. Powrie, Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature, 2011. 474(7351): p. 298-306.
5. Maslowski, K.M. and C.R. Mackay, Diet, gut microbiota and immune responses. Nat Immunol, 2011. 12(1): p. 5-9.
6. Desai, M.S., et al., A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell, 2016. 167(5): p. 1339-1353 e21.
7. Nickerson, K.P., et al., The dietary polysaccharide maltodextrin promotes Salmonella survival and mucosal colonization in mice. PLoS One, 2014. 9(7): p. e101789.
8. Nickerson, K.P. and C. McDonald, Crohn’s disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One, 2012. 7(12): p. e52132.
9. Chassaing, B., et al., Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. Gut, 2017. 66(8): p. 1414-1427.
10. Suez, J., et al., Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 2014. 514(7521): p. 181-6.
11. Ruiz, P.A., et al., Titanium dioxide nanoparticles exacerbate DSS-induced colitis: role of the NLRP3 inflammasome. Gut, 2017. 66(7): p. 1216-1224.
12. Mao, Z., et al., Exposure to Titanium Dioxide Nanoparticles During Pregnancy Changed Maternal Gut Microbiota and Increased Blood Glucose of Rat. Nanoscale Res Lett, 2019. 14(1): p. 26.
13. Bettini, S., et al., Food-grade TiO(2) impairs intestinal and systemic immune homeostasis, initiates preneoplastic lesions and promotes aberrant crypt development in the rat colon. Sci Rep, 2017. 7: p. 40373.
14. Guo, Y., et al., A diet high in sugar and fat influences neurotransmitter metabolism and then affects brain function by altering the gut microbiota. Transl Psychiatry, 2021. 11(1): p. 328.
15. Ianiro, G., H. Tilg, and A. Gasbarrini, Antibiotics as deep modulators of gut microbiota: between good and evil. Gut, 2016. 65(11): p. 1906-1915.
16. Ghosh, S., et al., Regulation of Intestinal Barrier Function by Microbial Metabolites. Cell Mol Gastroenterol Hepatol, 2021. 11(5): p. 1463-1482.
17. Ocvirk, S., et al., A prospective cohort analysis of gut microbial co-metabolism in Alaska Native and rural African people at high and low risk of colorectal cancer. Am J Clin Nutr, 2020. 111(2): p. 406-419.
18. Sanders, M.E., et al., Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nat Rev Gastroenterol Hepatol, 2019. 16(10): p. 605-616.
19. do Carmo, F.L.R., et al., Extractable Bacterial Surface Proteins in Probiotic-Host Interaction. Front Microbiol, 2018. 9: p. 645.
20. Lebeer, S., J. Vanderleyden, and S.C. De Keersmaecker, Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Nat Rev Microbiol, 2010. 8(3): p. 171-84.
21. Hutkins, R.W., Microbiology and technology of fermented foods. 2008: John Wiley & Sons.
22. Marco, M.L., et al., Health benefits of fermented foods: microbiota and beyond. Curr Opin Biotechnol, 2017. 44: p. 94-102.
23. Ebner, S., et al., Probiotics in dietary guidelines and clinical recommendations outside the European Union. World J Gastroenterol, 2014. 20(43): p. 16095-100.
24. Chilton, S.N., J.P. Burton, and G. Reid, Inclusion of fermented foods in food guides around the world. Nutrients, 2015. 7(1): p. 390-404.
25. Rul, F., et al., Underlying evidence for the health benefits of fermented foods in humans. Food Funct, 2022. 13(9): p. 4804-4824.
26. Olivares, M., et al., Dietary deprivation of fermented foods causes a fall in innate immune response. Lactic acid bacteria can counteract the immunological effect of this deprivation. J Dairy Res, 2006. 73(4): p. 492-8.
27. Chen, Y., et al., Yogurt improves insulin resistance and liver fat in obese women with nonalcoholic fatty liver disease and metabolic syndrome: a randomized controlled trial. Am J Clin Nutr, 2019. 109(6): p. 1611-1619.
28. Zarrati, M., et al., Effects of probiotic yogurt on fat distribution and gene expression of proinflammatory factors in peripheral blood mononuclear cells in overweight and obese people with or without weight-loss diet. J Am Coll Nutr, 2014. 33(6): p. 417-25.
29. van Meijl, L.E. and R.P. Mensink, Effects of low-fat dairy consumption on markers of low-grade systemic inflammation and endothelial function in overweight and obese subjects: an intervention study. Br J Nutr, 2010. 104(10): p. 1523-7.
30. Pei, R., et al., Premeal Low-Fat Yogurt Consumption Reduces Postprandial Inflammation and Markers of Endotoxin Exposure in Healthy Premenopausal Women in a Randomized Controlled Trial. J Nutr, 2018. 148(6): p. 910-916.
31. Bordoni, A., et al., Dairy products and inflammation: A review of the clinical evidence. Crit Rev Food Sci Nutr, 2017. 57(12): p. 2497-2525.
32. Rundblad, A., et al., Intake of Fermented Dairy Products Induces a Less Pro-Inflammatory Postprandial Peripheral Blood Mononuclear Cell Gene Expression Response than Non-Fermented Dairy Products: A Randomized Controlled Cross-Over Trial. Mol Nutr Food Res, 2020. 64(21): p. e2000319.
33. Nieman, K.M., B.D. Anderson, and C.J. Cifelli, The Effects of Dairy Product and Dairy Protein Intake on Inflammation: A Systematic Review of the Literature. J Am Coll Nutr, 2021. 40(6): p. 571-582.
34. Sugimura, T., et al., Immunomodulatory effect of Lactococcus lactis JCM5805 on human plasmacytoid dendritic cells. Clin Immunol, 2013. 149(3): p. 509-18.