Fonti di grasso alimentare e infiammazione
Alcuni fattori dietetici, o alcuni modelli alimentari, hanno una notevole capacità di influenzare il sistema immunitario e modulare lo stato di infiammazione cronica sistemica di basso grado
Scarica il numero di Ottobre 2022 de Lattendibile
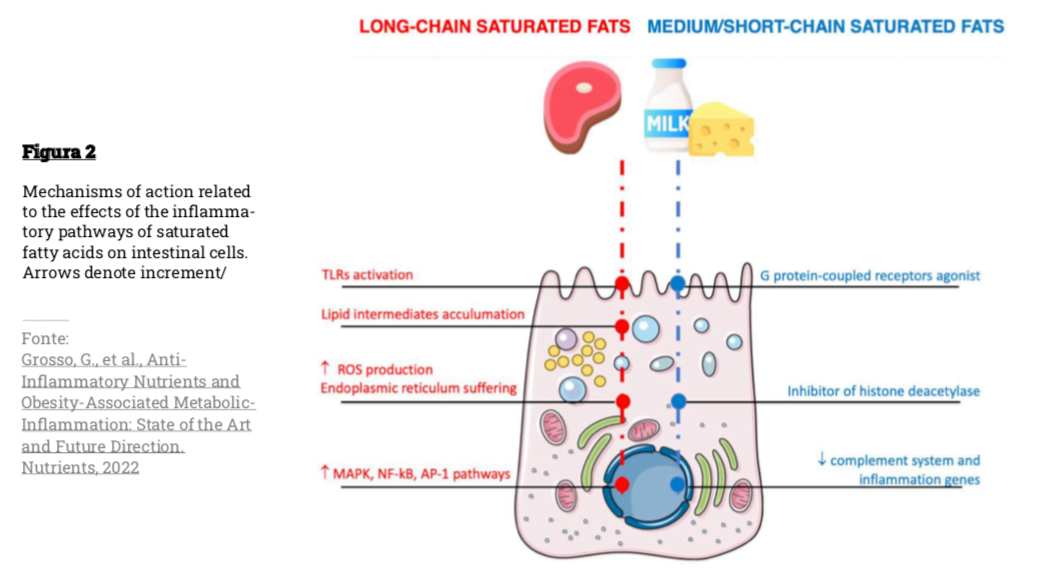
Come si vede in Figura 2 l’infiammazione può essere innescata da acidi grassi saturi a catena lunga attraverso l’attivazione della segnalazione TLR4 nella microglia, che porta al rilascio di citochine, al reclutamento di monociti e all’attivazione di serina/treonina chinasi intracellulare nei neuroni ipotalamici, che possono interferire con le proteine chiave dei sistemi di segnalazione della leptina e dell’insulina, interrompendo quindi i segnali adipostatici [28].
Come espresso anche in precedenza, uno stimolo acuto (pasto ricco di grassi) può essere in certo modo compensato in modo da ristabilire l’omeostasi, ma un consumo abbondante e prolungato nel tempo non permette la fase di risoluzione dell’infiammazione e il danno neuronale si cronicizza, con il risultato di una mancata risposta alla sazietà e ai fattori adipostatici, provocando predispo-sizione all’obesità.
Al contrario, gli acidi grassi a corta e media catena hanno vie metaboliche diverse: sono assorbiti in maniera efficiente nel tratto gastrointestinale e trasportati direttamente al fegato per una rapida ossidazione [28].
A differenza degli acidi grassi a catena lunga, gli acidi grassi a catena media e corta hanno dimostrato una serie di potenziali benefici per quanto riguarda gli esiti metabolici (Figura 2) [29]. Gli acidi grassi a catena media che provengono dai prodotti lattiero-caseari sovraregolano i geni correlati al ciclo dell’acido citrico e alla fosforilazione ossidativa (per lo più riguardante il metabolismo energetico nel tessuto adiposo) e sottoregolano i geni correlati al sistema del complemento e all’infiammazione [30].
Tra questi acidi grassi a corta catena, l’acido butirrico esercita una serie di funzioni nell’intestino, agendo come un inibitore dell’istone-deacetilasi e un agonista di specifici recettori accoppiati alle proteine G, dimostrando effetti benefici sugli esiti metabolici (cioè, miglioramento del metabolismo del glucosio, aumento dispendio energetico totale, livelli più bassi di lipidi nel sangue, ecc.).
Nei prodotti lattiero-caseari, inoltre, è presente un particolare gruppo di grassi saturi: gli acidi grassi a catena ramificata (BCFA), componenti alimentari bioattivi che costituiscono circa il 2% degli acidi grassi del latte vaccino. Sono grassi saturi con una o più ramificazioni sulla catena del carbonio, derivati dall’azione dei batteri del rumine; sono costituenti lipidici strutturali delle membrane dei batteri presenti nel rumine (e responsabili di caratteristiche strutturali come fluidità e permeabilità) che vengono successivamente assorbiti e incorporati nei grassi del latte [31].
Nella dieta umana l’assunzione di BCFA avviene principalmente attraverso il latte e i prodotti di derivazione e questi particolari acidi grassi possono spiegare, almeno in parte, i benefici per la salute associati a tale gruppo di alimenti anche (non solo) per ciò che attiene all’infiammazione. Infatti, diversi studi su varie linee cellulari hanno dimostrato che gli effetti antinfiammatori dei prodotti lattiero-caseari e dei BCFA potrebbero essere spiegati attraverso l’inibizione dell’espressione genica indotta da LPS delle classiche vie di trascrizione pro-infiammatoria (NF-kB e TLR) [32, 33].
Queste evidenze sono state confermate anche nel modello animale, in particolare su topi nutriti con BCFA che hanno mostrato una minore incidenza di enterocolite necrotizzante e una maggiore espressione di IL-10 [34], mentre gli studi sull’uomo, pur se sono piuttosto scarsi, dimostrano una correlazione inversa tra livelli ematici BCFA e livelli di CRP [35], confermando quindi uno dei meccanismi attraverso i quali i prodotti lattiero-caseari esercitano il loro effetto antiinfiammatorio.
Conclusioni
In conclusione, stanno emergendo sempre maggiori evidenze sugli effetti di alcuni alimenti e modelli alimentari sul sistema immunitario e sull’infiammazione di basso grado, anche se i meccanismi rilevati al momento rivelano una complessità maggiore a fronte di una maniera troppo semplicistica con la quale finora è stato trattato l’argomento. Tuttavia, incertezze a parte, ci sono evidenze di un certo peso che indicano in alcuni fattori dietetici, o in alcuni modelli alimentari, una notevole capacità di influenzare il sistema immunitario e modulare lo stato di infiammazione cronica sistemica di basso grado.
Anche considerando quindi l’infiammazione cronica di basso grado, i modelli alimentari a prevalente ma non esclusiva componente vegetale (come la dieta mediterranea), che si avvalgano anche degli effetti salutari di fonti proteiche animali come quelle dei latticini, sembra possano rappresentare una strategia cruciale per la riduzione del rischio di malattie non trasmissibili.
Autore: PROF. ANDREA GHISELLI, Medico Internista, Presidente SISA – Società Italiana di Scienze dell’Alimentazione
Bibliografia
- Grosso, G., et al., Anti-Inflammatory Nutrients and Obesity-Associated Metabolic-Inflammation: State of the Art and Future Direction. Nutrients, 2022. 14(6).
- Calder, P.C., et al., A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr, 2013. 109 Suppl 1: p. S1-34.
- Libby, P., Inflammation in atherosclerosis. Nature, 2002. 420(6917): p. 868-74.
- Hotamisligil, G.S., Inflammation and metabolic disorders. Nature, 2006. 444(7121): p. 860-7.
- Greten, F.R. and S.I. Grivennikov, Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity, 2019. 51(1): p. 27-41.
- Van’t Klooster, C.C., et al., The relation between systemic inflammation and incident cancer in patients with stable cardiovascular disease: a cohort study. Eur Heart J, 2019. 40(48): p. 3901-3909.
- Di Francesco, S., et al., Metabolic Alterations, Aggressive Hormone-Naive Prostate Cancer and Cardiovascular Disease: A Complex Relationship. Medicina (Kaunas), 2019. 55(3).
- Monti, D., et al., Inflammaging and human longevity in the omics era. Mech Ageing Dev, 2017. 165(Pt B): p. 129-138.
- Michaud, M., et al., Proinflammatory cytokines, aging, and age-related diseases. J Am Med Dir Assoc, 2013. 14(12): p. 877-82.
- Han, J.M. and M.K. Levings, Immune regulation in obesity-associated adipose inflammation. J Immunol, 2013. 191(2): p. 527-32.
- Furman, D., et al., Chronic inflammation in the etiology of disease across the life span. Nat Med, 2019. 25(12): p. 1822-1832.
- Seyedsadjadi, N. and R. Grant, The Potential Benefit of Monitoring Oxidative Stress and Inflammation in the Prevention of Non-Communicable Diseases (NCDs). Antioxidants (Basel), 2020. 10(1).
- Mohanty, P., et al., Both lipid and protein intakes stimulate increased generation of reactive oxygen species by polymorphonuclear leukocytes and mononuclear cells. The American Journal of Clinical Nutrition, 2002. 75(4): p. 767-772.
- Mohanty, P., et al., Glucose Challenge Stimulates Reactive Oxygen Species (ROS) Generation by Leucocytes. The Journal of Clinical Endocrinology & Metabolism, 2000. 85(8): p. 2970-2973.
- Esposito, K., et al., Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxidative stress. Circulation, 2002. 106(16): p. 2067-72.
- Camilleri, M., Leaky gut: mechanisms, measurement and clinical implications in humans. Gut, 2019. 68(8): p. 1516-1526.
- Wang, W., et al., Whole grain food diet slightly reduces cardiovascular risks in obese/overweight adults: a systematic review and meta-analysis. BMC Cardiovasc Disord, 2020. 20(1): p. 82.
- Fernandes, J., et al., Is olive oil good for you? A systematic review and meta-analysis on anti-inflammatory benefits from regular dietary intake. Nutrition, 2020. 69: p. 110559.
- Hosseini, B., et al., Effects of fruit and vegetable consumption on inflammatory biomarkers and immune cell populations: a systematic literature review and meta-analysis. Am J Clin Nutr, 2018. 108(1): p. 136-155.
- Salehi-Abargouei, A., et al., Effects of non-soy legume consumption on C-reactive protein: a systematic review and meta-analysis. Nutrition, 2015. 31(5): p. 631-9.
- Zampelas, A., et al., Fish consumption among healthy adults is associated with decreased levels of inflammatory markers related to cardiovascular disease: the ATTICA study. J Am Coll Cardiol, 2005. 46(1): p. 120-4.
- Moosavian, S.P., et al., Effects of dairy products consumption on inflammatory biomarkers among adults: A systematic review and meta-analysis of randomized controlled trials. Nutr Metab Cardiovasc Dis, 2020. 30(6): p. 872-888.
- van Woudenbergh, G.J., et al., Meat Consumption and Its Association With C-Reactive Protein and Incident Type 2 Diabetes: The Rotterdam Study. Diabetes Care, 2012. 35(7): p. 1499-1505.
- O’Connor, L.E., et al., Effects of Total Red Meat Intake on Glycemic Control and Inflammatory Biomarkers: A Meta-Analysis of Randomized Controlled Trials. Adv Nutr, 2021. 12(1): p. 115-127.
- Sajadi Hezaveh, Z., et al., Effect of egg consumption on inflammatory markers: a systematic review and meta-analysis of randomized controlled clinical trials. J Sci Food Agric, 2019. 99(15): p. 6663-6670.
- Neale, E.P., M.J. Batterham, and L.C. Tapsell, Consumption of a healthy dietary pattern results in significant reductions in C-reactive protein levels in adults: a meta-analysis. Nutr Res, 2016. 36(5): p. 391-401.
- Grosso, G., et al., Beneficial effects of the Mediterranean diet on metabolic syndrome. Curr Pharm Des, 2014. 20(31): p. 5039-44.
- Milanski, M., et al., Saturated fatty acids produce an inflammatory response predominantly through the activation of TLR4 signaling in hypothalamus: implications for the pathogenesis of obesity. J Neurosci, 2009. 29(2): p. 359-70.
- Schönfeld, P. and L. Wojtczak, Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res, 2016. 57(6): p. 943-54.
- Matualatupauw, J.C., et al., Dietary medium-chain saturated fatty acids induce gene expression of energy metabolism-related pathways in adipose tissue of abdominally obese subjects. Int J Obes (Lond), 2017. 41(9): p. 1348-1354.
- Taormina, V.M., et al., Branched-Chain Fatty Acids-An Underexplored Class of Dairy-Derived Fatty Acids. Nutrients, 2020. 12(9).
- Yan, Y., et al., BCFA suppresses LPS induced IL-8 mRNA expression in human intestinal epithelial cells. Prostaglandins Leukot Essent Fatty Acids, 2017. 116: p. 27-31.
- Yan, Y., et al., BCFA-enriched vernix-monoacylglycerol reduces LPS-induced inflammatory markers in human enterocytes in vitro. Pediatr Res, 2018. 83(4): p. 874-879.
- Ran-Ressler, R.R., et al., Branched chain fatty acids reduce the incidence of necrotizing enterocolitis and alter gastrointestinal microbial ecology in a neonatal rat model. PLoS One, 2011. 6(12): p. e29032.
- Mika, A., et al., A comprehensive study of serum odd- and branched-chain fatty acids in patients with excess weight. Obesity (Silver Spring), 2016. 24(8): p. 1669-76.
Scarica il numero di Ottobre 2022 de Lattendibile
I latticini e i prodotti della pesca si comportano in maniera simile agli alimenti di origine vegetale, diminuendo sensibilmente gli indici infiammatori.

Modelli alimentari e infiammazione cronica di basso grado

Stress (ossidativo) post-prandiale