Stress (ossidativo) post-prandiale
L’entità dello stress ossidativo e dell’infiammazione mediati dal pasto e dalla dieta dipendono in gran parte dalla composizione dei macronutrienti del cibo ingerito
Scarica il numero di Ottobre 2022 de Lattendibile
Fisiologicamente, in seguito ad un pasto, l’equilibrio redox si sposta verso l’ossidazione e ciò è dovuto alla produzione di H2O2, alla deplezione di GSH e all’incremento di radicali liberi dell’ossigeno per la metabolizzazione di nutrienti per l’ottenimento dell’energia. La perdita della neutralità redox, verso uno stato più ossidato comporta la produzione di fattori di trascrizione, come NF-kB, l’attivazione di geni proinfiammatori con produzione di citochine pro-infiammatorie (interleuchi-ne, TNF-alfa e interferone) [12].
L’entità dello stress ossidativo e dell’infiammazione mediati dal pasto e dalla dieta dipendono in gran parte dalla composizione dei macronutrienti del cibo ingerito: una quantità isocalorica (300 calorie) di glucosio (75 g), di grassi (33 g) o di proteine (75 g) in soggetti normali dimostra un effetto diverso sullo stress ossidativo: le proteine hanno effetti minimi, mentre i grassi (saturi) quello maggiore [13, 14].
L’assunzione di glucosio in soggetti non diabetici induce anche altre alterazioni infiammatorie acute a livello cellulare e molecolare per almeno 3 ore. In soggetti obesi con ridotta tolleranza al glucosio, gli effetti sono più intensi e prolungati [14, 15].
La risposta ossidativa/infiammatoria è modulata anche da una serie di molecole antiossidanti/antiinfiammatorie presenti nella dieta, soprattutto nei prodotti vegetali.
I differenti modelli alimentari possono portare, inoltre, a modificazioni acute e croniche del microbiota intestinale. Quando l’alterazione del microbiota intestinale si mantiene nel tempo, si altera anche la permeabilità intestinale, con possibile entrata in circolo di materiale di vario tipo, che sarebbe altrimenti destinato all’eliminazione attraverso le feci (materiale alimentare, tossine, frammenti di materiale batterico come i lipopolisaccaridi o LPS).
L’intestino ha diverse linee di difesa che proteggono dalla traslocazione di microrganismi o prodotti microbici nel flusso sanguigno, ed è una barriera multistrato che rappresenta la più grande interfaccia con l‘ambiente esterno. Quando però questo sistema viene eluso o è in qualche modo maggiormente permeabile, materiale estraneo entra nel circolo ematico e il sistema immunitario reagisce principalmente con infiammazione dando vita ad un’ampia varietà di problemi di salute, sia di poco conto come affaticamento, allergie e ipersensibilità alimentari, produzione di gas e cefalea, sia condizioni più gravi, come malattie autoimmuni, infiammatorie intestinali, depressione e altri disturbi dell’umore, diabete, malattie cardiovascolari, cancro [16].
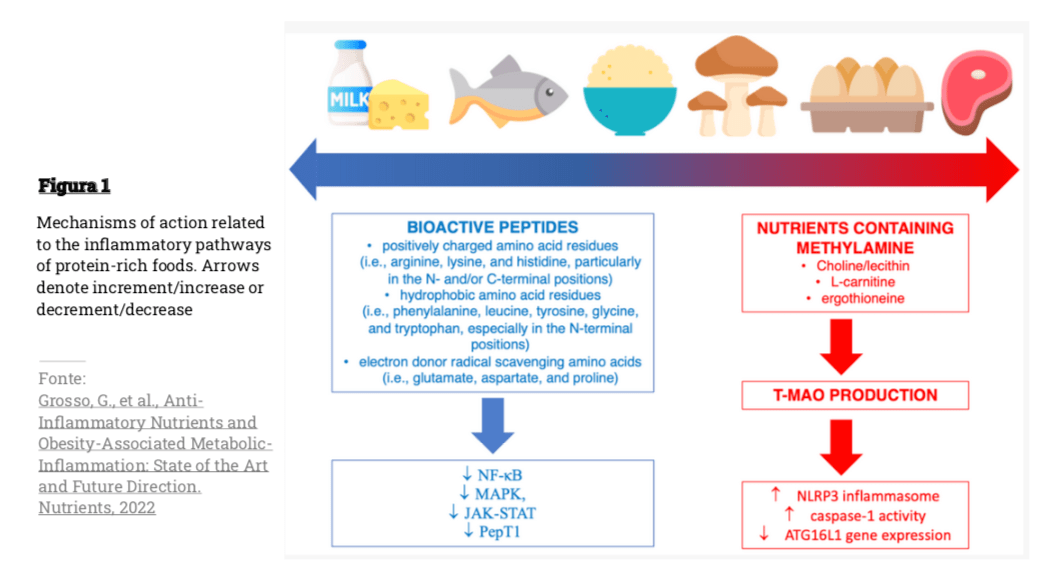
La perdita di equilibrio tra i diversi fila batterici, con maggiore abbondanza di Firmicutes rispetto ai Bacteroides, porta all’attivazione della via di segnalazione TLR (un variegato gruppo di recettori che riconosce diverse molecole del modello molecolare associate ai patogeni) e una maggiore permeabilità alle endotossine i LPS, componenti della parete cellulare batterica dei Gram-negativi. LPS possono traslocare nella circolazione sistemica attraverso l’assorbimento di fattori dietetici (transcellulari) o attraverso giunzioni strette degli enterociti (paracellulari) [1]. (vedi Figura 1).
L’aumento della secrezione di mediatori dell’infiammazione da parte dei macrofagi e dei linfociti T, come IL-6, innesca l’espressione degli epatociti e il rilascio della CPR.
Alimenti, gruppi di alimenti e infiammazione
Il consumo di alimenti di origine vegetale, come i cereali integrali, la frutta, la verdura, l’olio extravergine di oliva e i legumi, è associato ad una significativa riduzione dei livelli dei markers infiammatori, misurati attraverso il dosaggio della CPR [17-20].
Tra i prodotti di derivazione animale, invece, i latticini e i prodotti della pesca si comportano in maniera simile agli alimenti di origine vegetale, diminuendo sensibilmente gli indici infiammatori [21, 22], al contrario di quanto succede per la carne rossa (sia fresca che trasformata) e per le uova, che alcuni studi trovano neutre o al contrario correlate ad aumento dei markers di infiammazione [23-25].
Gli studi sui singoli alimenti o gruppi di alimenti sono molto utili per capire i meccanismi attraverso i quali determinati alimenti o loro componenti influiscano su determinati target, nel nostro caso l’infiammazione, ma una descrizione più precisa e mirata la possiamo ottenere dagli studi sui modelli alimentari e gli stili di vita, che descrivono meglio quello che succede nella vita di tutti i giorni, durante la quale gli alimenti vengono consumati in diverse combinazioni e i nutrienti interagiscono tra loro con effetti sinergici o antagonisti.
La maggior parte delle prove che derivano dalle meta-analisi degli studi di intervento dimostra in maniera piuttosto evidente che la dieta mediterranea o la dieta DASH (una dieta mediterranea applicata alla prevenzione dell’ipertensione) [26] possono portare a una significativa diminuzione dei markers infiammatori rispetto a modelli diversi di tipo occidentale (Figura 2).
La dieta mediterranea è un modello alimentare le cui caratteristiche possono essere riassunte in un maggiore ed elevato consumo di alimenti di origine vegetale, come frutta, verdura, cereali integrali e derivati, noci e legumi, un consumo moderato di latticini, uova e pesce come fonti di proteine e un basso consumo di carni rosse, prodotti ultraprocessati e dolciumi.
Tradotto in nutrienti, quella mediterranea può essere considerata una dieta povera di grassi saturi e ricca di grassi monoinsaturi e polinsaturi, oltre che da un elevato apporto di fibre, vitamine e molecole non nutrienti, ma di elevato interesse nutrizionale per la prevenzione delle malattie croniche come antiossidanti e altre sostanze fito-chimiche [27].
Autore: PROF. ANDREA GHISELLI, Medico Internista, Presidente SISA – Società Italiana di Scienze dell’Alimentazione
Bibliografia
- Grosso, G., et al., Anti-Inflammatory Nutrients and Obesity-Associated Metabolic-Inflammation: State of the Art and Future Direction. Nutrients, 2022. 14(6).
- Calder, P.C., et al., A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr, 2013. 109 Suppl 1: p. S1-34.
- Libby, P., Inflammation in atherosclerosis. Nature, 2002. 420(6917): p. 868-74.
- Hotamisligil, G.S., Inflammation and metabolic disorders. Nature, 2006. 444(7121): p. 860-7.
- Greten, F.R. and S.I. Grivennikov, Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity, 2019. 51(1): p. 27-41.
- Van’t Klooster, C.C., et al., The relation between systemic inflammation and incident cancer in patients with stable cardiovascular disease: a cohort study. Eur Heart J, 2019. 40(48): p. 3901-3909.
- Di Francesco, S., et al., Metabolic Alterations, Aggressive Hormone-Naive Prostate Cancer and Cardiovascular Disease: A Complex Relationship. Medicina (Kaunas), 2019. 55(3).
- Monti, D., et al., Inflammaging and human longevity in the omics era. Mech Ageing Dev, 2017. 165(Pt B): p. 129-138.
- Michaud, M., et al., Proinflammatory cytokines, aging, and age-related diseases. J Am Med Dir Assoc, 2013. 14(12): p. 877-82.
- Han, J.M. and M.K. Levings, Immune regulation in obesity-associated adipose inflammation. J Immunol, 2013. 191(2): p. 527-32.
- Furman, D., et al., Chronic inflammation in the etiology of disease across the life span. Nat Med, 2019. 25(12): p. 1822-1832.
- Seyedsadjadi, N. and R. Grant, The Potential Benefit of Monitoring Oxidative Stress and Inflammation in the Prevention of Non-Communicable Diseases (NCDs). Antioxidants (Basel), 2020. 10(1).
- Mohanty, P., et al., Both lipid and protein intakes stimulate increased generation of reactive oxygen species by polymorphonuclear leukocytes and mononuclear cells. The American Journal of Clinical Nutrition, 2002. 75(4): p. 767-772.
- Mohanty, P., et al., Glucose Challenge Stimulates Reactive Oxygen Species (ROS) Generation by Leucocytes. The Journal of Clinical Endocrinology & Metabolism, 2000. 85(8): p. 2970-2973.
- Esposito, K., et al., Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxidative stress. Circulation, 2002. 106(16): p. 2067-72.
- Camilleri, M., Leaky gut: mechanisms, measurement and clinical implications in humans. Gut, 2019. 68(8): p. 1516-1526.
- Wang, W., et al., Whole grain food diet slightly reduces cardiovascular risks in obese/overweight adults: a systematic review and meta-analysis. BMC Cardiovasc Disord, 2020. 20(1): p. 82.
- Fernandes, J., et al., Is olive oil good for you? A systematic review and meta-analysis on anti-inflammatory benefits from regular dietary intake. Nutrition, 2020. 69: p. 110559.
- Hosseini, B., et al., Effects of fruit and vegetable consumption on inflammatory biomarkers and immune cell populations: a systematic literature review and meta-analysis. Am J Clin Nutr, 2018. 108(1): p. 136-155.
- Salehi-Abargouei, A., et al., Effects of non-soy legume consumption on C-reactive protein: a systematic review and meta-analysis. Nutrition, 2015. 31(5): p. 631-9.
- Zampelas, A., et al., Fish consumption among healthy adults is associated with decreased levels of inflammatory markers related to cardiovascular disease: the ATTICA study. J Am Coll Cardiol, 2005. 46(1): p. 120-4.
- Moosavian, S.P., et al., Effects of dairy products consumption on inflammatory biomarkers among adults: A systematic review and meta-analysis of randomized controlled trials. Nutr Metab Cardiovasc Dis, 2020. 30(6): p. 872-888.
- van Woudenbergh, G.J., et al., Meat Consumption and Its Association With C-Reactive Protein and Incident Type 2 Diabetes: The Rotterdam Study. Diabetes Care, 2012. 35(7): p. 1499-1505.
- O’Connor, L.E., et al., Effects of Total Red Meat Intake on Glycemic Control and Inflammatory Biomarkers: A Meta-Analysis of Randomized Controlled Trials. Adv Nutr, 2021. 12(1): p. 115-127.
- Sajadi Hezaveh, Z., et al., Effect of egg consumption on inflammatory markers: a systematic review and meta-analysis of randomized controlled clinical trials. J Sci Food Agric, 2019. 99(15): p. 6663-6670.
- Neale, E.P., M.J. Batterham, and L.C. Tapsell, Consumption of a healthy dietary pattern results in significant reductions in C-reactive protein levels in adults: a meta-analysis. Nutr Res, 2016. 36(5): p. 391-401.
- Grosso, G., et al., Beneficial effects of the Mediterranean diet on metabolic syndrome. Curr Pharm Des, 2014. 20(31): p. 5039-44.
- Milanski, M., et al., Saturated fatty acids produce an inflammatory response predominantly through the activation of TLR4 signaling in hypothalamus: implications for the pathogenesis of obesity. J Neurosci, 2009. 29(2): p. 359-70.
- Schönfeld, P. and L. Wojtczak, Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res, 2016. 57(6): p. 943-54.
- Matualatupauw, J.C., et al., Dietary medium-chain saturated fatty acids induce gene expression of energy metabolism-related pathways in adipose tissue of abdominally obese subjects. Int J Obes (Lond), 2017. 41(9): p. 1348-1354.
- Taormina, V.M., et al., Branched-Chain Fatty Acids-An Underexplored Class of Dairy-Derived Fatty Acids. Nutrients, 2020. 12(9).
- Yan, Y., et al., BCFA suppresses LPS induced IL-8 mRNA expression in human intestinal epithelial cells. Prostaglandins Leukot Essent Fatty Acids, 2017. 116: p. 27-31.
- Yan, Y., et al., BCFA-enriched vernix-monoacylglycerol reduces LPS-induced inflammatory markers in human enterocytes in vitro. Pediatr Res, 2018. 83(4): p. 874-879.
- Ran-Ressler, R.R., et al., Branched chain fatty acids reduce the incidence of necrotizing enterocolitis and alter gastrointestinal microbial ecology in a neonatal rat model. PLoS One, 2011. 6(12): p. e29032.
- Mika, A., et al., A comprehensive study of serum odd- and branched-chain fatty acids in patients with excess weight. Obesity (Silver Spring), 2016. 24(8): p. 1669-76.
Scarica il numero di Ottobre 2022 de Lattendibile
I latticini e i prodotti della pesca si comportano in maniera simile agli alimenti di origine vegetale, diminuendo sensibilmente gli indici infiammatori.

Modelli alimentari e infiammazione cronica di basso grado

Stress (ossidativo) post-prandiale